担当:寺島 裕也(tera{a}rs.tus.ac.jp)
免疫細胞の動きと活性をコントロールして新薬を患者さんへ届ける研究
免疫細胞遊走とは、炎症時に分泌されるケモカイン/サイトカイン、生理活性脂質などの遊走因子の刺激を受け、免疫細胞が血管内から組織内に浸潤し、迅速に炎症局所へ移動・集積する現象です。免疫細胞遊走は生体を防御する免疫機構に必須な現象であるとともに、がん、および、関節リウマチ、動脈硬化症などの慢性炎症性疾患にも密接に関与しています。私たちが発見した新規ケモカイン受容体会合分子「フロント」によるケモカインシグナルの分子制御メカニズムに関する基礎研究と、そこから得られた知見を活かし、がんおよび慢性炎症性疾患を治療する新薬の候補物質を探索する創薬開発研究を行っています。最近では、フロントが細胞遊走のみならず、細胞の活性化や分極化などこれまで考えられていた以上に多様な生命現象に関与していることが明らかになりつつあります。それに伴い、当グループでは様々な分野の研究者の方々との連携を通して研究を進めております。
基礎研究~免疫細胞遊走メカニズムの解明
免疫細胞遊走機構解明の新たな切り口
細胞遊走にはケモカイン受容体の細胞膜近傍C末端領域(Pro-C)を欠損させると遊走に障害がでることから、この領域は細胞遊走に重要な働きをしていると考えられてきました。しかしながらこの領域が具体的に何をしているのかは不明でした。私たちはこの領域には細胞遊走機構のカギとなる未知の分子が結合すると考え、その探索を行いました。標的としたケモカイン受容体はCCR2です。CCR2はマクロファージや樹状細胞、活性化T細胞に発現し、炎症時のこれらの免疫細胞の動きを制御しています。わたしたちはマクロファージ細胞株のcDNAライブラリーから、CCR2のPro-C領域に結合し、かつ細胞遊走を促進する作用をもつ新規分子を発見し、「フロント」と命名しました(Nature Immunology 2005: 発表論文等①、IF:27.0)。
免疫細胞の動きと活性を制御する分子フロント
生体内では免疫細胞は非常に希薄なケモカイン濃度勾配を感知して炎症局所に移動していると考えられます。濃度勾配を感知した細胞では遊走細胞に特徴的な前後の極性をもった形態をとりますが、これに先立って細胞内の細胞骨格を制御する分子配置に極性が生じています。細胞先導端にてPI3Kが活性化し、細胞骨格制御の実効分子のひとつであるPIP3を産生します。ただ、ケモカイン受容体の細胞表面における均一な分布と、PI3Kの活性化との間にはギャップがあり、分子配置の極性化を誘導する初期シグナル機構はまだよくわかっていません。私たちはフロントとPI3Kの関わりを解析し、フロントがPI3K活性化の制御に関わり、細胞遊走を促進することを明らかにしました(図1、図2)。現在、フロントの機能解析とファミリー分子の探索を行っています。
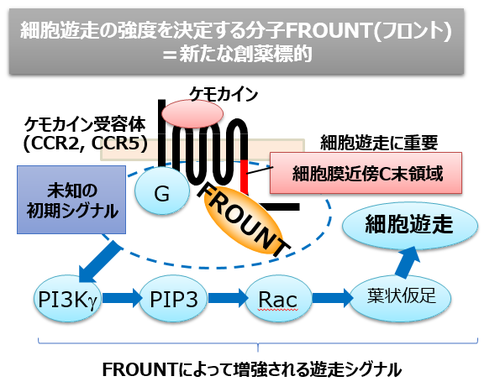
図1)ケモカインシグナルを制御する「フロント」
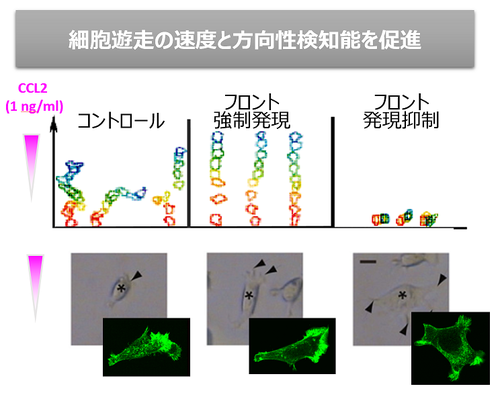
図2)「フロント」はケモカインシグナル促進分子
応用研究~免疫細胞を調節する新薬の開発
免疫細胞の働きを調節できる物質の探索
フロントの特性として、動物種間で高度に保存されている、ケモカイン受容体(CCR2とCCR5)に作用することを見いだしました(J. Immunology. 2009:発表論文等②、IF:4.9、Biochem. J. 2014: 発表論文等③, IF:3.8)。これは創薬のターゲットとして大きなメリットです。炎症性疾患の治療薬として、炎症の原因となる細胞の遊走を媒介するケモカインの作用を阻害する薬の開発が世界中で行われています。その多くがケモカインとケモカイン受容体の結合を阻害するものですが、ケモカイン受容体の細胞外領域は種差が大きいために開発段階において実験動物では効果があっても臨床試験では効果が得られない、副作用が大きいといった問題から、これまでに開発は成功していません。私たちは、フロントはこうした潜在的な問題を払拭するがんや炎症性疾患治療薬の新しいターゲットであると考え、フロントの機能を調節する物質の探索を行いました(図3)。
この13万種類以上の化合物からFROUNT阻害活性がある化合物を多段階の創薬スクリーニングを通して探索した結果、これまでアルコール依存症治療薬として臨床で使用されているジスルフィラムにフロント阻害活性があることを発見しました(図4)。
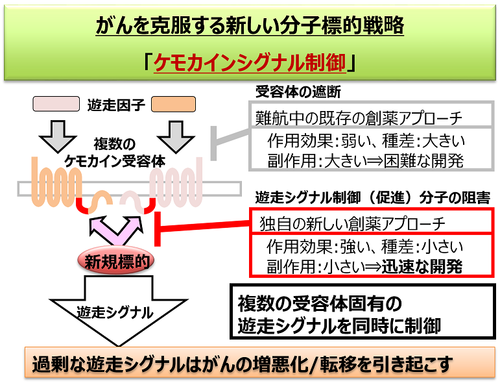
図3)「フロント」制御薬に期待されるメリット

図4)「フロント」制御薬の開発概要
新薬の実用化を目指す応用研究
がんを移植したマウスへジスルフィラムを投与することで、がんを悪化させるマクロファージの働きをコントロールでき、がんを抑制できることを見いだしました。そして、フロントを欠損させたマウスはがんに抵抗性を示すこと、さらには様々ながんの患者さんにおいてフロントの発現量が低い患者さんほどがん部位のマクロファージの数が少なく、手術後の予後が良いことを発見して、フロントが新しいがん治療のための創薬標的分子であり、アルコール依存症治療薬であるジスルフィラムの服用することでフロントの機能を阻害できることを明らかにしました(Nature Communications 2020: 発表論文等④、IF:14.9、図5)。
プレスリリース: https://www.tus.ac.jp/today/archive/20200130009.html
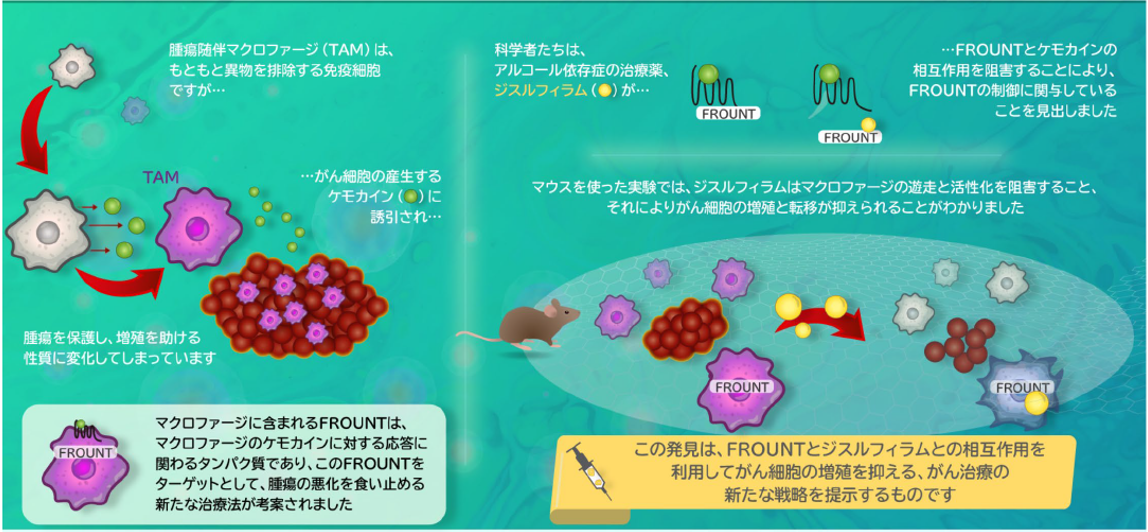
図5) フロントを制御する「既存薬ジスルフィラム」でマクロファージをコントロールしてがんを治療する
ジスルフィラムと免疫チェックポイント阻害薬とを併用することで、マウスのがんをより強力に抑制できることを報告しました。免疫チェックポイント阻害薬は、リンパ球の働きを増強する抗がん剤として近年臨床で使用されているものの効きのよくないがん患者さんも多く、問題となっております。そこで、私たちの研究結果はフロント阻害薬と免疫チェックポイント阻害薬を併用するというがんに対する新しい治療戦略の可能性を提唱しました。現在、国立がん研究センターの先生方にご協力いただきまして、がん患者さんに免疫チェックポイント阻害薬の治療と同時にフロント阻害薬、ジスルフィラムを服用していただく臨床研究を進めております(臨床研究実施計画番号:jRCTs031180183:発表論文等⑤)。
最近、多くの研究分野の先生方と共同研究を通して炎症性疾患や精神神経疾患などの様々な疾患の悪化におけるフロントタンパクの関与について研究を展開させていただいております。
東京理科大学薬学部の斎藤先生グループとの共同研究でフロント阻害薬であるジスルフィラムの新しい薬効として抗不安作用を見いだしました。これは臨床で使用されている抗不安薬であるジアゼパムと同等の強力な薬効で、かつ運動障害や記憶力低下のような既存薬のような副作用は示さないことを報告しました(Frontiers in Pharmacology 2022: 発表論文等⑥, IF:5.8)。
プレスリリース: https://www.tus.ac.jp/today/archive/20220414_3208.html
日本医科大学の遠田助教・清水教授グループとの共同研究では、糸球体基底膜(GBM)に対する自己抗体が原因で発症し、腎不全の原因となる抗GBM抗体型腎炎モデルを用いた解析を通して、フロント阻害薬ジスルフィラムが腎疾患に有効性を示す可能性を明らかにしました(Kidney International. 2022:発表論文等⑦, IF:19.0、図6)。
プレスリリース: https://www.tus.ac.jp/today/archive/20221121_8267.html
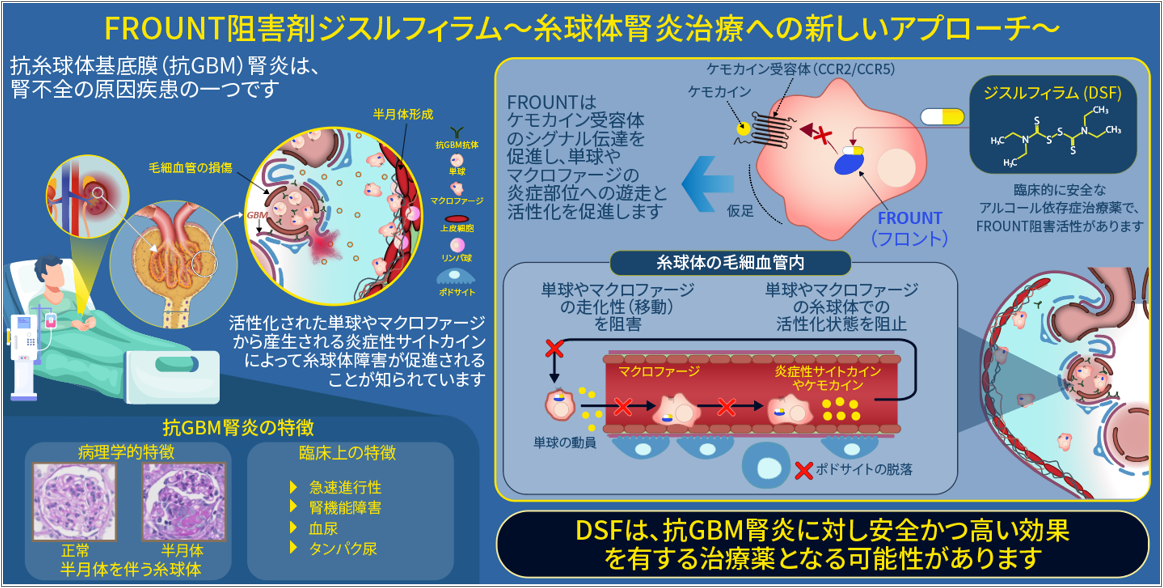
図6)「フロント阻害既存薬ジスルフィラムは腎疾患に有効性な可能性を示す」
このように、これまで細胞の動きと活性化を調節するタンパクとして発見したフロントタンパクの基礎研究を通して、がんや炎症性疾患、精神神経疾患などの様々な疾患に共通する病態悪化の分子メカニズムを解明してきました。 そして、この研究成果を基盤として、フロント機能を制御する物質を見いだし、この薬効や安全性などを解析する非臨床研究と臨床研究を推進することではじめて患者さんのもとへ届けることがでます。また、この研究を通して得られた知見を新薬の探索技術や疾患の新たな診断技術として活用することもできます。これらは実用化研究といわれ、これまでは大学などのアカデミアではなく、製薬企業の仕事と考えられることも多かった研究開発です。本邦での医薬品開発には、アカデミアにおける基礎研究成果を製薬企業へ橋渡しの問題を抱えています。私たちは新薬や新たな診断技術の実用化までを見据えた基礎・応用研究を推進してこの状況を変えたいと考えております。
日本発の新薬や、新たな診断技術の実用化に興味のある学生さんはお気軽に寺島(tera@rs.tus.ac.jp)までご連絡ください。
おもな発表論文など
① Terashima, Y. (1/12 : 筆頭著者)、Matsushima, K*. Pivotal function for cytoplasmic protein FROUNT in CCR2-mediated monocyte chemotaxis. Nature Immunology. 2005, 6(8):827
② Toda E、Terashima, Y. (2/6: 共同筆頭著者)、Matsushima, K*. FROUNT is a common regulator of CCR2 and CCR5 signaling to control directional migration. J Immunology. 2009 183(10):6387
③ Toda, E.、Terashima, Y. * (責任著者:2/11)、Matsushima, K*. Identification of a binding element for the cytoplasmic regulator FROUNT in the membrane-proximal carboxy-terminal region of chemokine receptors CCR2 and CCR5. Biochem. J. 2014, 457:313
④ Terashima, Y. * (筆頭著者&責任著者:1/27)、Matsushima K. Targeting FROUNT with disulfiram suppresses macrophage accumulation and its tumor-promoting properties. Nature Communications 2020, 11:609.
プレスリリース: https://www.tus.ac.jp/today/archive/20200130009.html
⑤ https://rctportal.niph.go.jp/detail/jr?trial_id=jRCTs031180183 切除不能な進行・再発胃がん患者を対象としたDisulfiramとNivolumabの同時併用療法に関する臨床研究、臨床研究実施計画番号:jRCTs031180183
⑥ Saito, Y.、Terashima, Y. (最終著者:18/18)、Disulfiram Produces Potent Anxiolytic-Like Effects Without Benzodiazepine Anxiolytics-Related Adverse Effects in Mice. Frontiers in Pharmacology 2022, 13:826783
プレスリリース: https://www.tus.ac.jp/today/archive/20220414_3208.html
⑦ Toda, E*. Terashima, Y. (17/18)、Akira, S*. Inhibition of the chemokine signal regulator FROUNT by disulfiram ameliorates crescentic glomerulonephritis. Kidney International. 2022, 102:1000
プレスリリース: https://www.tus.ac.jp/today/archive/20221121_8267.html
