担当:上羽 悟史(ueha{a}rs.tus.ac.jp)
七野 成之(s_shichino{a}rs.tus.ac.jp)
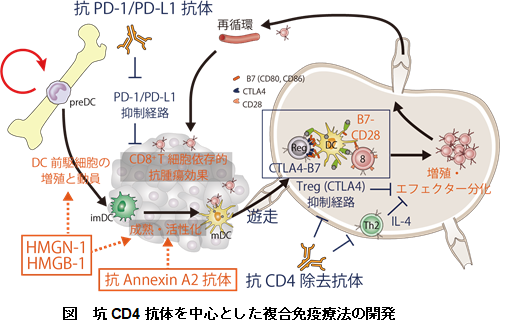
がんに対する新規複合免疫療法の臨床開発
近年、CTLA-4やPD-1などの免疫応答を抑制するImmune-Checkpoint分子に対する中和抗体ががん治療に大きなインパクトを与えました。私たちは、マウス皮下腫瘍モデルでは、坑CD4除去抗体により制御性T細胞を含むCD4+ 細胞全体を広範かつ完全に除去することで、Immune-Checkpoint抗体を上回る強い腫瘍特異的CD8+ T細胞応答の活性化や抗腫瘍効果がえられることを明らかにしました。また、坑CD4抗体と抗PD-1/PDL-1抗体との併用は劇的な相乗効果をもたらし、一部の腫瘍モデルでは完全退縮と免疫メモリーを確立しました(Ueha et al. Cancer Immunol Res. 2015)。私達は2018年現在、進行・再発固形がん患者を対象として強力な除去活性を持つヒト型化抗CD4抗体IT1208の第I相医師主導臨床治験を進めています。さらに、より強力な複合免疫療法の開発や免疫治療戦略の最適化に必要な細胞動態の解明を目指した基礎研究をすすめるとともに、特異的な免疫応答を高感度に検出するために独自のTCRレパトア解析手法を開発し、免疫治療前後でのレパトア応答解析を進めています。
蛍光レポーターを用いた免疫担当細胞の動態解析
骨髄不全などの特殊な状況を除き、炎症組織に浸潤する単球の起源は骨髄と考えられてきました。このドグマに対して、2009年に脾臓貯留性単球(splenic reservoir monocytes)という概念が提唱され、腫瘍を含む種々の急性・慢性炎症モデルにおいて、脾臓で増殖し動員される単球の重要性が注目されました。私たちは脾臓貯留性単球がどの程度腫瘍免疫を抑制するとされる腫瘍会合性マクロファージに寄与しているかを検証するため、紫光(435nm)照射により蛍光特性が緑から赤へ変換される蛍光タンパク質“KikGR”を全身性に発現する遺伝子改変マウスを用いて皮下腫瘍モデルを作成しました。外科的に露出させた脾臓または骨髄に紫光を照射し、照射臓器に存在するLy-6Chi炎症性単球を色変換した後、経時的に脾臓、骨髄、末梢血、腫瘍に存在する赤色細胞を追跡した。いずれの臓器を照射した場合でも、1時間以内に赤色細胞が末梢血に出現し、その後腫瘍、脾臓、骨髄へ再分布しましたが、腫瘍へ動員される単球数としては骨髄由来単球が脾臓由来単球を大きく上回っていました。また、数学的処理により算出した末梢血から腫瘍への移行効率、腫瘍局所における残存時間も骨髄由来単球が脾臓由来単球を上回っており、機能的な違いもあることがわかりました。さらに、細胞周期レポーターFucci(fluorescent ubiquitination-based cell-cycle indicator)トランスジェニックマウスを用いて脾臓および骨髄に存在するG1/S/G2期にある単球の細胞数を定量したところ、脾臓における単球の髄外増殖は限定的であるという結果を得ました。これらの結果から、少なくとも皮下腫瘍モデルにおいて腫瘍会合性マクロファージの起源は主に骨髄であり、脾臓貯留性単球の寄与は限定的であることが分かりました。KikGRおよびFucciなどの蛍光レポーターマウスが、種々の炎症条件下における単球の臓器間移動や臓器内残存時間、また機能特性や細胞老化などを明らかにし、新たなドグマを打ち立てる強力なツールになることを期待して基礎研究を進めています。